
Wasser ist flüssig. Allerdings kann es auch gefrieren oder kochen, und dann ist es nicht mehr flüssig. Wie macht das Wasser das?
Sieden und gefrieren
Wasser, haben wir schon gehört, besteht aus winzigen Teilchen, den Wassermolekülen. Die befinden sich in ständiger Bewegung. Je wärmer es wird, desto schneller bewegen sich die Moleküle. Sie haben aber eine schwache Verbindung zueinander, so als würden sie durch dünne Gummifäden miteinander verbunden sein. Je höher die Temperatur steigt, desto dünner werden die Gummifäden. Bis sie irgendwann reißen.

Jetzt können die Wassermoleküle ungebremst durch die Gegend flitzen. Aus der Flüssigkeit Wasser, in der die Moleküle wie durch Gummifäden aneinander hingen, ist Wassergas geworden – die Moleküle können sich jetzt frei bewegen.
Diesen Vorgang, bei dem aus einer Flüssigkeit ein Gas wird, nennt man sieden, und die Temperatur, bei der es passiert, nennt man Siedepunkt.
Wasser im gasförmigen Zustand sieht man nicht, weil es genau so aussieht wie die umgebende Luft, nämlich unsichtbar. Wenn man aber aus Versehen seine Hand über einen Topf oder Kessel mit kochendem Wasser hält, kann man sich richtig schwer verletzen, weil das unsichtbare Wassergas, das vom Topf oder Kessel nach oben steigt, heißer als 100 Grad Celsius ist, was unserer Haut nicht gut tut.
Wenn wir das Wassergas wieder abkühlen, werden die Gas-Moleküle wieder langsamer. Am Siedepunkt fangen sie wieder an, sich mit Gummifäden zu verbinden.

Sie werden immer langsamer, und irgendwann sausen sie nicht mehr herum, sondern schwingen nur noch um einen Ort.
Mit ihren Gummifäden halten die einzelnen Moleküle sich gegenseitig fest. Sie stellen sich dabei sehr ordentlich auf: Sie bilden ein Kristallgitter.
Dieser Zustand heißt Eis.
Das flüssige Wasser ist zu Eis gefroren, und die Temperatur, bei der es geschieht, ist der Gefrierpunkt. Er liegt bei Null Grad Celsius.
Im Eisgitter bewegen sich die Wassermoleküle immer noch: Sie schwingen um ihren Platz herum. Wenn es kälter wird, schwingen sie immer langsamer.
Bis sie zum vollständigen Stillstand kommen. Das passiert am absoluten Nullpunkt der Temperatur bei minus 273,15 Grad Celsius.
Wasser kommt in der Natur in allen drei Aggregatzuständen vor, also fest, flüssig und gasförmig. Fest im Winter, sonst meistens flüssig, und in der Luft ist auch bei niedrigen Temperaturen immer etwas Wassergas aufgelöst, das nennt man die „Luftfeuchtigkeit“. Wenn die Luft sehr trocken ist, also die Luftfeuchtigkeit sehr gering, wenn also nur sehr wenig Wassergas in der Luft aufgelöst ist, ist das ganz schlecht für unsere Atemorgane, weil die dann austrocknen. Also ist es gut, dass immer etwas Wassergas in der Luft aufgelöst ist.
Dass Wasser auf der Erde in der Natur in allen drei Aggregatzuständen vorkommt, ist überhaupt nicht selbstverständlich. Tatsächlich ist Wasser der einzige Stoff, bei dem das so ist, und die Erde ist der einzige Planet in unserem Sonnensystem, auf dem festes, flüssiges und gasförmiges Wasser vorkommt.
Je wärmer die Luft ist, desto mehr Wassergas kann sie aufnehmen. Das sehen wir an kalten Wintertagen: die Luft, die wir ausatmen, bildet kleine Dampfwolken. Unsere Atemluft ist nämlich ziemlich warm, und sie enthält reichlich Wassergas, das, wie wir wissen, unsichtbar ist. Wenn wir diese warme und feuchte Luft nun in die kalte Umgebung ausatmen, passt nicht mehr so viel Wassergas in die jetzt kalte Luft, wie zuvor darin gelöst war. Was nicht mehr passt, wird flüssig, und zwar in Form von winzig kleinen Tröpfchen, die so klein und leicht sind, dass sie in der Luft schweben können. Das ist der Hauch, den wir sehen. So eine Mischung aus Wassergas und schwebenden kleinen Wassertröpfchen nennt man Dampf.
Dampf kennen wir vom Kochen in der Küche, Dampf kommt aus Schornsteinen und Kühltürmen von Kraftwerken, und aus Dampf bestehen auch die Wolken.
Hier gibt es ein Spiel:
Verdunstung

Eine Frage vorweg: Wenn man im Winter bei Temperaturen unter dem Gefrierpunkt Wäsche zum Trocknen nach draußen hängt, was passiert dann mit der Wäsche?
a) Sie gefriert erst einmal und trocknet dann langsam.
b) Sie bleibt bretthart gefroren und trocknet erst im Frühling.
Eine der tollen Eigenschaften des Wassers ist, dass es, ohne zwischendurch flüssig zu werden, direkt vom festen in den gasförmigen Aggregatzustand übergehen kann. Wie macht das Wasser das?
Um das zu verstehen, lassen wir eine kleine Schale flüssiges Wasser bei Zimmertemperatur ein paar Tage offen in der Küche herum stehen. Danach ist das Wasser weg. Klar: Dieser Vorgang ist uns allen bekannt, wir nennen ihn „verdunsten“. Aber wie kommt das? Wo ist das Wasser abgeblieben?
Es ist zu Wassergas geworden und dieses Gas wurde in der umgebenden Luft gelöst.
Moment! Flüssiges Wasser wird beim Siedepunkt, also bei 100°C, gasförmig. In unserer Küche herrschen aber nicht derart höllische Temperaturen.
Schauen wir uns noch einmal an, was beim Sieden passiert: die Teilchen des flüssigen Wassers werden immer schneller, bis sie den Kontakt zueinander verlieren.
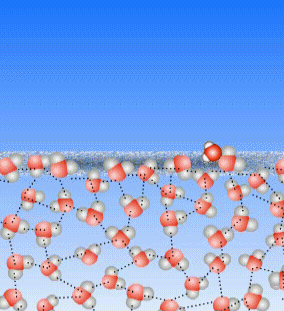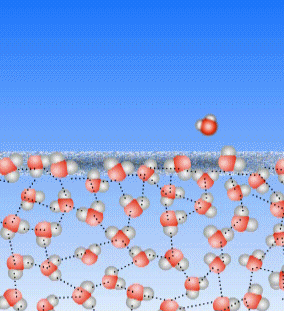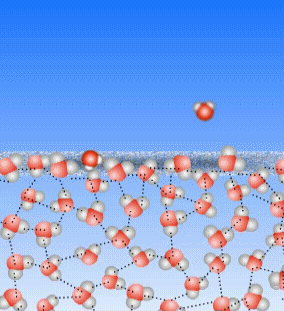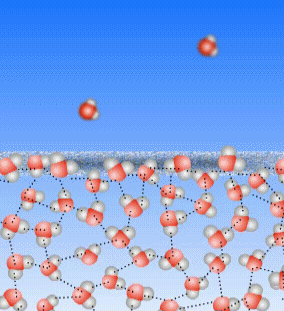
Bei Temperaturen weit unterhalb des Siedepunktes bleiben die Teilchen im Allgemeinen aneinander hängen. Manchmal aber bekommt ein Teilchen an der Wasseroberfläche von den benachbarten Teilchen so viele Stöße ab, dass es aus dem Zusammenhalt der Teilchen heraus gestoßen wird. Dann wird dieses Teilchen gasförmig. Auch weit unterhalb von 100°C.
Oberhalb der Wasseroberfläche ist im Allgemeinen Luft, und die besteht auch aus kleinen Teilchen, die, weil Luft ja ein Gas ist, sich sehr schnell bewegen. Auch diese Luft-Teilchen können einzelne Wasser-Teilchen anstoßen und aus dem Zusammenhalt der Wasser-Teilchen heraus stoßen.
Das ist die Verdunstung
Und tatsächlich passiert diese Verdunstung auch bei festem Wasser, also Eis, nur viel seltener, weil die Eis- und Luft-Teilchen sich langsamer bewegen. Eis kann also verdunsten, ohne vorher flüssig geworden zu sein. Also ist die korrekte Antwort auf unsere Quizfrage a): Die bretthart gefrorene Wäsche wird, wenn wir ihr genug Zeit lassen, auch im kalten Winter trocken.
Verdunstungskälte
Damit Wasser verdampft, also vom flüssigen in den gasförmigen Aggregatzustand übergeht, müssen wir es erhitzen. Wir führen also Energie zu.
Wenn Wasser verdunstet, wenn also unterhalb des Siedepunktes von 100°C einzelne Wasser-Teilchen flüssigen in den gasförmigen Aggregatzustand übergehen, müssen diese schneller werden als der Rest der Teilchen, und dafür brauchen auch sie zusätzliche Energie. Woher soll die kommen?
Wenn die benachbarten Wasser-Teilchen ein Teilchen so sehr anstoßen, dass es verdunsten kann, werden sie selbst langsamer, sie verlieren einen Teil ihrer Energie. Das ist wie bei einer Billardkugel, die eine andere Kugel anstößt: die angestoßene Kugel rollt weg, die anstoßende Kugel wird langsamer oder bleibt sogar liegen.
Dasselbe gilt für die Luft-Teilchen, die ein Wasser-Teilchen aus dem Wasser heraus stoßen: sie verlieren einen Teil ihrer Energie, werden also langsamer. Wenn die Teilchen eines Stoffes langsamer werden, heißt das aber nichts anderes, als dass der Stoff kälter wird.
Wenn Wasser verdunstet, wird seine Umgebung kälter. Die Wissenschaftler sagen: Die Verdunstung entzieht der Umgebung die für die Verdunstung nötige Energie.Diese Eigenschaft macht sich unser Körper bei hohen Temperaturen zu Nutze: wir schwitzen, der Schweiß verdunstet, und so kühlen wir die Haut ab. Übrigens gilt dasselbe auch für den Schmelzpunkt: Um Wasser zum Schmelzen zu bringen, muss man Energie herein stecken, oder das Wasser muss sich die Energie aus der Umgebung holen. Diese Umgebung wird dann kälter, dazu gibt es ein

